परमाणु का बोर मॉडल: Difference between revisions
Listen
| Line 5: | Line 5: | ||
== हाइड्रोजन परमाणु हेतु बोर मॉडल == | == हाइड्रोजन परमाणु हेतु बोर मॉडल == | ||
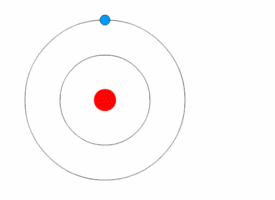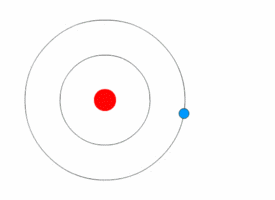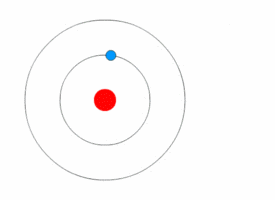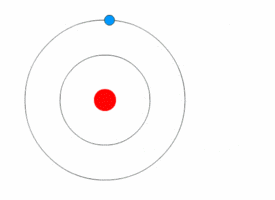
[[File:Bohr atom model.svg|thumb|नील्स बोर द्वारा प्रस्तुत परमाणु का मॉडल]] | [[File:Bohr atom model.svg|thumb|नील्स बोर द्वारा प्रस्तुत परमाणु का मॉडल]] | ||
<math>\Delta E</math>हाइड्रोजन परमाणु की संरचना तथा इसके वर्णक्रम के सामान्य लक्षणों की प्रथम मात्रात्मक व्याख्या नील्स बोर ने सन् 1913 में की। उन्होंने प्लांक के ऊर्जा के प्रमात्रीकरण की अवधारणा का प्रयोग किया। यद्यपि बोर सिद्धान्त आधुनिक प्रमात्रा यान्त्रिकी नहीं था, तथापि परमाणु संरचना तथा वर्णक्रमों में कई बातों को तर्कसंगत रूप से समझाने में इसका उपयोग किया जा सकता है। बोर का मॉडल निम्नलिखित अभिगृहीतों पर आधारित है: | <math>\Delta E</math> हाइड्रोजन परमाणु की संरचना तथा इसके वर्णक्रम के सामान्य लक्षणों की प्रथम मात्रात्मक व्याख्या नील्स बोर ने सन् 1913 में की। उन्होंने प्लांक के ऊर्जा के प्रमात्रीकरण की अवधारणा का प्रयोग किया। यद्यपि बोर सिद्धान्त आधुनिक प्रमात्रा यान्त्रिकी नहीं था, तथापि परमाणु संरचना तथा वर्णक्रमों में कई बातों को तर्कसंगत रूप से समझाने में इसका उपयोग किया जा सकता है। बोर का मॉडल निम्नलिखित अभिगृहीतों पर आधारित है: | ||
* हाइड्रोजन परमाणु में इलेक्ट्रॉन, नाभिक के चतुर्दिक् निश्चित त्रिज्या और ऊर्जा वाले वृत्ताकार पथों में घूम सकता है। इन वृत्ताकार पक्षों को कक्षा या स्थायी अवस्था या अनुमत उर्जा स्तर कहते हैं। ये कक्षाएँ नाभिक के चतुर्दिक् सकेन्द्रीय रूप में व्यवस्थित होती हैं। | * हाइड्रोजन परमाणु में इलेक्ट्रॉन, नाभिक के चतुर्दिक् निश्चित त्रिज्या और ऊर्जा वाले वृत्ताकार पथों में घूम सकता है। इन वृत्ताकार पक्षों को कक्षा या स्थायी अवस्था या अनुमत उर्जा स्तर कहते हैं। ये कक्षाएँ नाभिक के चतुर्दिक् सकेन्द्रीय रूप में व्यवस्थित होती हैं। | ||
Latest revision as of 15:05, 24 September 2024
Bohr's model of atom
परमाणु भौतिकी में, बोर मॉडल सन १९१३ में नील्स बोर तथा रदर्फ़ोर्ड द्वारा सम्मिलित रूप से प्रस्तुत किया गया था। इस मॉडल के अनुसार परमाणु के केन्द्रीय भाग में छोटा, धनात्मक आवेश वाला नाभिक होता है तथा उसके चारो ओर वृत्ताकार कक्षा में इलेक्ट्रॉन चक्कर लगाते हैं। यह मॉडल सौर मण्डल के मॉडल जैसा ही है, अन्तर केवल इतना है कि यहाँ इलेक्ट्रॉनों की वृत्तीय गति के लिए आवश्यक अभिकेन्द्रीय बल नाभिक में स्थित धनावेशित प्रोटॉनों एवं ऋणावेशित इलेक्ट्रॉनों के बीच के आकर्षण बल से मिलता है, गुरुत्वाकर्षण से नहीं। यह मॉडल, रदरफोर्ड के परमाणु मॉडल में थोड़ा सुधार करके किया गया है- इसके प्रमात्रा यान्त्रिकी का सहारा लिया गया है।
हाइड्रोजन परमाणु हेतु बोर मॉडल
हाइड्रोजन परमाणु की संरचना तथा इसके वर्णक्रम के सामान्य लक्षणों की प्रथम मात्रात्मक व्याख्या नील्स बोर ने सन् 1913 में की। उन्होंने प्लांक के ऊर्जा के प्रमात्रीकरण की अवधारणा का प्रयोग किया। यद्यपि बोर सिद्धान्त आधुनिक प्रमात्रा यान्त्रिकी नहीं था, तथापि परमाणु संरचना तथा वर्णक्रमों में कई बातों को तर्कसंगत रूप से समझाने में इसका उपयोग किया जा सकता है। बोर का मॉडल निम्नलिखित अभिगृहीतों पर आधारित है:
- हाइड्रोजन परमाणु में इलेक्ट्रॉन, नाभिक के चतुर्दिक् निश्चित त्रिज्या और ऊर्जा वाले वृत्ताकार पथों में घूम सकता है। इन वृत्ताकार पक्षों को कक्षा या स्थायी अवस्था या अनुमत उर्जा स्तर कहते हैं। ये कक्षाएँ नाभिक के चतुर्दिक् सकेन्द्रीय रूप में व्यवस्थित होती हैं।
- कक्षा में इलेक्ट्रॉन की ऊर्जा समय के साथ नहीं परिवर्तित होती है, तथापि कोई इलेक्ट्रॉन निम्न स्थायी स्तर से उच्च स्थायी स्तर पर तब जाएगा, जब वह आवश्यक ऊर्जा का अवशोषित करेगा अथवा इलेक्ट्रॉन के उच्च स्थायी स्तर से निम्न स्तर पर आने के बाद ऊर्जा का उत्सर्जन होगा । ऊर्जा परिवर्तन सतत तरीके से नहीं होता है।
- के अंतर वाली दो स्थायी अवस्थाओं के संक्रमण के समय अवशोषित अथवा उत्सर्जित विकिरण को निम्नलिखित रूप में दिया जा सकता है-
जहाँ E1, तथा E2, क्रमशः निम्न और उच्च अनुमत ऊर्जावस्थाएँ हैं और h प्लांक स्थिरांक है। इस समीकरण को बोर का आवृत्ति का नियम कहा जाता है।
- इलेक्ट्रॉन का कोणीय संवेग प्रमात्रित होता है, दी हुई स्थायी अवस्था में इसे निम्नलिखित समीकरण के द्वारा दर्शाया जा सकता है-
जहाँ इलेक्ट्रॉन का द्रव्यमान वेग तथा उस कक्षा की त्रिज्या है जिसमें इलेक्ट्रॉन घूमता हैं। अतः एक इलेक्ट्रॉन केवल उन्हीं कक्षों में घूम सकता है, जिनमें कोणीय संवेग का मान का पूर्णांक गुणक होगा। इसका अर्थ है कोणीय संवेग प्रमात्रित होता है।
संक्षेप में
जब इलेक्ट्रॉन कोणीय संवेग के किसी एक प्रमात्रित मान को छोड़कर दूसरा मान प्राप्त करता है तो विकिरण का अवशोषण अथवा उत्सर्जन होता है। अत: मैक्स्वेल का विद्युच्चुम्बकीय सिद्धान्त यहाँ लागू नहीं होता। यही कारण है कि कुछ निश्चित कक्ष ही अनुमत होते हैं।